 En la actualidad, se considera que los estudios inmunofenotípicos deben incluirse en la caracterización diagnóstica de las enfermedades hematologícas en general, y de las leucemias en particular. Su uso clínico en el diagnóstico, caracterización y el seguimiento de las leucemias como herramienta útil ha dado buenos resultados durante la evolución de la enfermedad, mediante la evaluación de la respuesta al tratamiento y el seguimiento de enfermedad mínima residual.
En la actualidad, se considera que los estudios inmunofenotípicos deben incluirse en la caracterización diagnóstica de las enfermedades hematologícas en general, y de las leucemias en particular. Su uso clínico en el diagnóstico, caracterización y el seguimiento de las leucemias como herramienta útil ha dado buenos resultados durante la evolución de la enfermedad, mediante la evaluación de la respuesta al tratamiento y el seguimiento de enfermedad mínima residual.
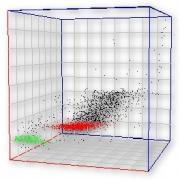
La citometría de flujo multiparamétrica es el método de elección para la caracterización inmunofenotípica de las células hematopoyéticas presentes en los distintos procesos leucémicos crónicos y/o agudos mediante la unión de sitios específicos con anticuerpos marcados con fluorocromos con el objetivo de analizar la expresión de antígenos de membrana celular.
Los marcadores involucrados en el estudio del Inmunofenotipo son cCD3, CD5, CD8, CD10, CD11a, CD15, CD19, CD20, CD33, CD34, CD38, CD45, cCD79a, CD79b, CD117, HLA-DR, TdT y cMPO.
Se estima que alrededor del 5-10% de todos los tumores, tiene un carácter hereditario, son consecuencia de mutaciones genéticas que incrementan la posibilidad de desarrollar la enfermedad.
Esta susceptibilidad a padecer cáncer se va transmitiendo a la descendencia a lo largo de distintas generaciones.
Aunque haber heredado una mutación genética que predisponga al cáncer hereditario no supone una certeza de que llegue a desarrollarse, la identificación de esta mayor susceptibilidad permite iniciar medidas orientadas a la detección precoz y la prevención de los tumores.
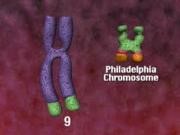
El cromosoma Philadelphia (Ph), es un cromosoma 22 acortado que resulta de la fusión entre el segmento 3′ del protoncogen ABL, localizado en el cromosoma 9, y la región 5′ del gen BCR del cromosoma 22. Esta translocación t (9; 22) genera un gen híbrido BCR/ABL, que se transcribe en un RNA quimérico. Existen dos regiones principales de corte dentro del gen BCR que, a su vez, generan dos proteínas diferentes. Una región se denomina Mbcr (Major Breakpoint Cluster Region) que abarca los exones b1-b5 del gen BCR y codifica una proteína de 210 kD (p210). La translocación a nivel de la región mBCR (Minor Breakpoint Cluster Region), genera una proteína de 190 kD (p190). Ambas proteínas de fusión tienen su actividad tirosín-quinasa aumentada, así como capacidad de transformación neoplásica.
La forma p210 de la proteína hibrida BCR/ABL se asocia prácticamente a la totalidad de las leucemias mieloides crónicas (LMC) y a un 50% de las leucemias linfoblásticas agudas del adulto (LAL Ph+). El 50% restante de las LAL Ph+, portan la forma p190.
 La translocación t (8; 21) (q22; q22) es una de las alteraciones genéticas encontradas con más frecuencia en las Leucemias Agudas Mieloblásticas (LAM). La frecuencia de aparición de esta alteración en el subtipo LAM- M2 se acerca al 40 %. Como resultado de la translocación, el gen que codifica el factor de transcripción AML1, localizado en el cromosoma 21, se fusiona con el gen ETO, localizado en el cromosoma 8, resultando de ello la formación de una proteína quimérica AML1/ETO que parece jugar un papel crítico en el establecimiento del clon leucémico.
La translocación t (8; 21) (q22; q22) es una de las alteraciones genéticas encontradas con más frecuencia en las Leucemias Agudas Mieloblásticas (LAM). La frecuencia de aparición de esta alteración en el subtipo LAM- M2 se acerca al 40 %. Como resultado de la translocación, el gen que codifica el factor de transcripción AML1, localizado en el cromosoma 21, se fusiona con el gen ETO, localizado en el cromosoma 8, resultando de ello la formación de una proteína quimérica AML1/ETO que parece jugar un papel crítico en el establecimiento del clon leucémico.
Las características moleculares de este reordenamiento, obligan a realizar la detección del tránscrito de fusión mediante la técnica de RT-PCR, la cual por su alta especifidad es de gran utilidad tanto para el diagnóstico como para la monitorización de la enfermedad residual en esta patología.
 La leucemia aguda promielocítica aguda (LAM-M3) es una expansión clonal de precursores hematopoyéticos bloqueados en el estadío promielocítico. Más de un 90% de los casos se acompañan de un reordenamiento que implica a los genes RARa, localizado en el cromosoma 17 y PML en el cromosoma 15. Este reordenamiento recíproco se origina por una translocación t(15;17) (q22;q21) que presenta un único punto de corte en RAR y tres posibles puntos en PML, lo que determina la existencia de tres tipos de proteínas de fusión PML/ RAR: bcr1, bcr2 y bcr3. Cada una de estas variantes provoca diferencias patogénicas y pronósticas a la enfermedad.
La leucemia aguda promielocítica aguda (LAM-M3) es una expansión clonal de precursores hematopoyéticos bloqueados en el estadío promielocítico. Más de un 90% de los casos se acompañan de un reordenamiento que implica a los genes RARa, localizado en el cromosoma 17 y PML en el cromosoma 15. Este reordenamiento recíproco se origina por una translocación t(15;17) (q22;q21) que presenta un único punto de corte en RAR y tres posibles puntos en PML, lo que determina la existencia de tres tipos de proteínas de fusión PML/ RAR: bcr1, bcr2 y bcr3. Cada una de estas variantes provoca diferencias patogénicas y pronósticas a la enfermedad.
En la actualidad, se considera que los estudios inmunofenotípicos deben incluirse en la caracterización diagnóstica de las enfermedades hematologícas en general, y de las leucemias en particular. Su uso clínico en el diagnóstico, caracterización y el seguimiento de las leucemias como herramienta útil ha dado buenos resultados durante la evolución de la enfermedad, mediante la evaluación de la respuesta al tratamiento y el seguimiento de enfermedad mínima residual.
La citometría de flujo multiparamétrica es el método de elección para la caracterización inmunofenotípica de las células hematopoyéticas presentes en los distintos procesos leucémicos crónicos y/o agudos mediante la unión de sitios específicos con anticuerpos marcados con fluorocromos con el objetivo de analizar la expresión de antígenos de membrana celular.
Los marcadores involucrados en el estudio del Inmunofenotipo son cCD3, CD5, CD8, CD10, CD11a, CD15, CD19, CD20, CD33, CD34, CD38, CD45, cCD79a, CD79b, CD117, HLA-DR, TdT y cMPO.

Se estima que alrededor del 5-10% de todos los tumores, tiene un carácter hereditario, son consecuencia de mutaciones genéticas que incrementan la posibilidad de desarrollar la enfermedad.
Esta susceptibilidad a padecer cáncer se va transmitiendo a la descendencia a lo largo de distintas generaciones.
Aunque haber heredado una mutación genética que predisponga al cáncer hereditario no supone una certeza de que llegue a desarrollarse, la identificación de esta mayor susceptibilidad permite iniciar medidas orientadas a la detección precoz y la prevención de los tumores.
El cromosoma Philadelphia (Ph), es un cromosoma 22 acortado que resulta de la fusión entre el segmento 3′ del protoncogen ABL, localizado en el cromosoma 9, y la región 5′ del gen BCR del cromosoma 22. Esta translocación t (9; 22) genera un gen híbrido BCR/ABL, que se transcribe en un RNA quimérico. Existen dos regiones principales de corte dentro del gen BCR que, a su vez, generan dos proteínas diferentes. Una región se denomina Mbcr (Major Breakpoint Cluster Region) que abarca los exones b1-b5 del gen BCR y codifica una proteína de 210 kD (p210). La translocación a nivel de la región mBCR (Minor Breakpoint Cluster Region), genera una proteína de 190 kD (p190). Ambas proteínas de fusión tienen su actividad tirosín-quinasa aumentada, así como capacidad de transformación neoplásica.
La forma p210 de la proteína hibrida BCR/ABL se asocia prácticamente a la totalidad de las leucemias mieloides crónicas (LMC) y a un 50% de las leucemias linfoblásticas agudas del adulto (LAL Ph+). El 50% restante de las LAL Ph+, portan la forma p190.

La translocación t (8; 21) (q22; q22) es una de las alteraciones genéticas encontradas con más frecuencia en las Leucemias Agudas Mieloblásticas (LAM). La frecuencia de aparición de esta alteración en el subtipo LAM- M2 se acerca al 40 %. Como resultado de la translocación, el gen que codifica el factor de transcripción AML1, localizado en el cromosoma 21, se fusiona con el gen ETO, localizado en el cromosoma 8, resultando de ello la formación de una proteína quimérica AML1/ETO que parece jugar un papel crítico en el establecimiento del clon leucémico.
Las características moleculares de este reordenamiento, obligan a realizar la detección del tránscrito de fusión mediante la técnica de RT-PCR, la cual por su alta especifidad es de gran utilidad tanto para el diagnóstico como para la monitorización de la enfermedad residual en esta patología.

La leucemia aguda promielocítica aguda (LAM-M3) es una expansión clonal de precursores hematopoyéticos bloqueados en el estadío promielocítico. Más de un 90% de los casos se acompañan de un reordenamiento que implica a los genes RARa, localizado en el cromosoma 17 y PML en el cromosoma 15. Este reordenamiento recíproco se origina por una translocación t(15;17) (q22;q21) que presenta un único punto de corte en RAR y tres posibles puntos en PML, lo que determina la existencia de tres tipos de proteínas de fusión PML/ RAR: bcr1, bcr2 y bcr3. Cada una de estas variantes provoca diferencias patogénicas y pronósticas a la enfermedad.
